中国首款干细胞治疗药品获批上市,干细胞创新药领域迎来重大突破
AI导读:
中国首款干细胞治疗药品艾米迈托赛注射液获批上市,标志着中国在干细胞创新药领域取得重大突破。该药品将用于治疗急性移植物抗宿主病,同时干细胞领域的伦理、定价等问题也将逐渐清晰。
干细胞创新药领域的重大突破!1月2日,国家药监局通过优先审评审批程序,附条件批准了我国首款干细胞治疗药品艾米迈托赛注射液上市,该药品专门用于治疗14岁以上、消化道受累为主的激素治疗失败的急性移植物抗宿主病(aGVHD)。这一里程碑事件标志着中国在干细胞创新药研发领域取得了重大进展。
这款由铂生卓越生物科技(北京)有限公司(铂生卓越)研发的干细胞产品,与FDA批准的首款间充质基质细胞疗法Ryoncil的获批时间仅相差半个月,验证了中国将在2025年获批同类产品的预测。这不仅表明中国在干细胞创新药的全球竞争中与美国并驾齐驱,还预示着干细胞创新药商业化浪潮的来临。同时,围绕干细胞领域的伦理、定价等问题也将逐渐清晰。
受该利好消息影响,1月3日A股干细胞概念板块逆势上涨。其中,中源协和(600645.SH)报21.09元/股,涨幅达7.99%;冠昊生物(300238.SZ)报12.28元/股,上涨3.72%。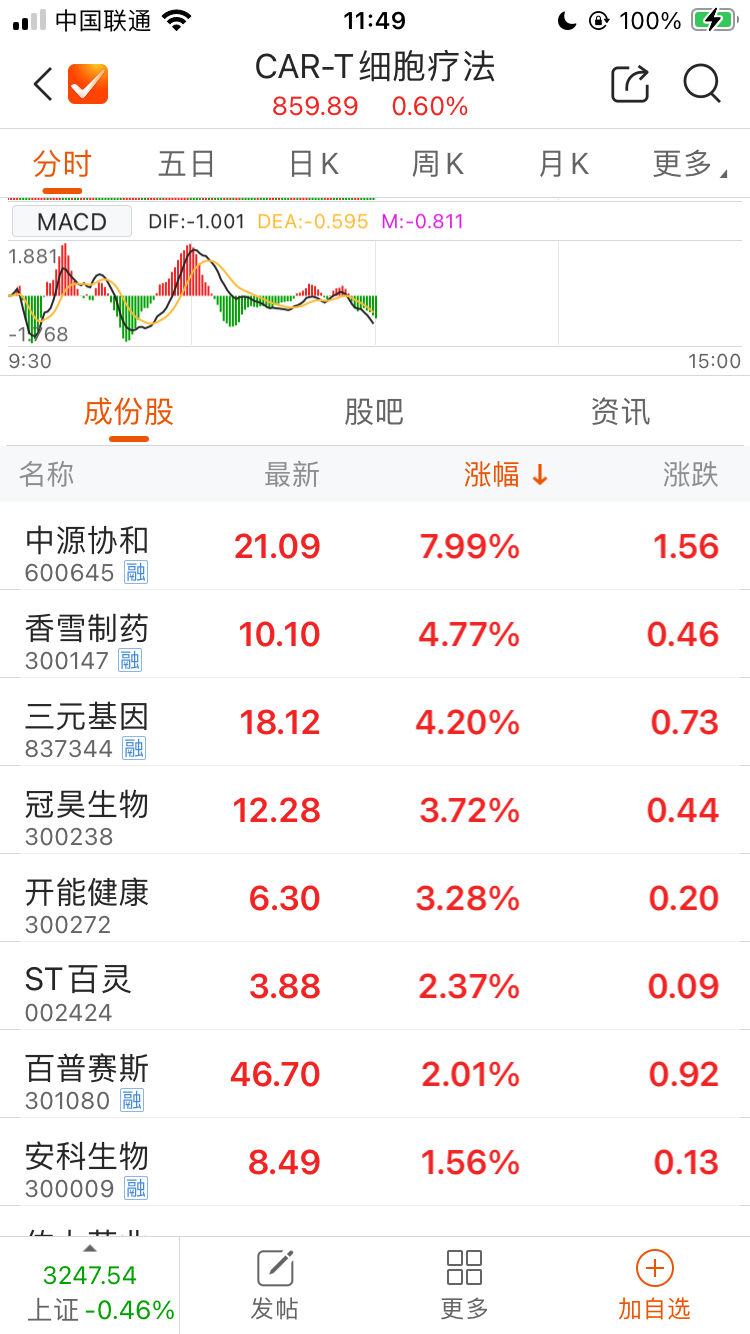
▌政策与科研“双突破”引领行业发展
此次艾米迈托赛注射液的获批,不仅体现了中美两国在干细胞疗法领域的同步发展,更彰显了中国在干细胞治疗领域的政策与科研双突破。据悉,该药品获批用于治疗14岁以上人群,适用人群更广,且生产工艺更先进。投资人王笑(化名)在朋友圈中表示,中国获批产品的细胞生产工艺为全封闭自动化3D培养,而美国则为手工工艺。
另一名投资人林熙(化名)指出,该产品的获批具有里程碑意义,主要体现在监管方面。细胞治疗产品与其他药物有本质区别,往往没有现成的标准,因此审批过程较为复杂。此次艾米迈托赛注射液的获批,标志着中国和美国在干细胞疗法审批标准上达成了一致。
铂生卓越获批的干细胞疗法与美国获批的Ryoncil(remestemcel-L-rknd)是同一类适应征。移植物抗宿主病(aGVHD)是异基因造血干细胞移植术后主要并发症之一,严重时可能导致死亡。艾米迈托赛注射液作为处方药上市,将在医院凭医生处方用于治疗相应疾病。
据Insight数据库显示,艾米迈托赛是一款间充质干细胞疗法(MSC)。自2024年6月被CDE纳入优先审评审批以来,该药品的上市进程加速推进。同时,北京市药监局也核发了全国第一张干细胞《药品生产许可证》,获得者正是铂生卓越。
近年来,中国在干细胞领域的研究和临床转化方面取得了显著进展。自2015年国家发布《干细胞临床研究管理办法(试行)》等文件以来,近10年间,行业逐步走向合规化发展。特别是在2024年,国家进一步加强对干细胞技术的支持力度,发布了一系列实质性指导文件。
《海南自由贸易港博鳌乐城国际医疗旅游先行区生物医学新技术促进规定》等政策的发布,为细胞治疗等生物医学新技术的发展提供了强有力的政策支持。同时,北京等地也发布了相关行动方案,推动干细胞与基因治疗产业的创新发展。
2024年,中国干细胞科研也取得了重大突破。中国科研团队成功运用化学重编程技术,将多能干细胞转化为胰岛细胞,并移植至一名I型糖尿病患者体内,实现了糖尿病的功能性治愈突破。这表明中国在干细胞领域的研究已经处于世界前沿。
▌间充质干细胞药物研发蓬勃发展
干细胞是一类具有多向分化潜能的细胞,按照来源和功能可以分为不同类型。其中,间充质干细胞(MSCs)具有自我更新和多系分化能力,广泛分布于人体各组织器官。目前全球获批上市的间充质干细胞治疗药品约10个,其中用于治疗急性移植物抗宿主病(aGVHD)的有4款。
据前瞻报告数据显示,截至2024年10月,我国共有148例干细胞药物获IND申请受理,其中106例已获批。从已获批IND的细胞类型来看,间充质干细胞药物合计78例,占比73.6%,是干细胞药物研发最主要的细胞类型。此次获批的艾米迈托赛也是一款间充质干细胞疗法(MSC)。
虽然间充质干细胞药物的研发蓬勃发展,但一些潜在问题也逐渐凸显。有观点认为,目前国内针对MSC的临床研究同质化比较明显,以效仿国外研究方案为主,针对中国人群的“本地化”方案仍然比较有限。对此,有临床研发人员认为,平衡好政策对新技术的支持和监管尺度非常重要。
▌诱导性多能干细胞(iPSC)成为下一个风口
相比技术较为成熟的间充质干细胞,多位采访对象表示更关注诱导性多能干细胞(iPSC)技术。iPSC技术具有巨大的潜力和应用前景,被誉为“龙卷风”。仅2024年11月,就有两家iPSC领域的企业获得融资。
其中,瑞普晨创宣布完成超亿元A轮融资,将用于合作开发干细胞治疗业务,包括人多能干细胞向胰岛细胞诱导分化技术领域。另一家行业佼佼者中盛溯源也宣布完成1.5亿元B轮融资首关,将加速推进iPSC细胞治疗领域多款临床管线的开发。
中盛溯源已有两款药物获得国家药监局药品审评中心(CDE)临床试验默示许可,包括用于治疗膝骨关节炎的iPSC来源间充质样细胞产品NCR100注射液和用于治疗骨髓增生异常综合征的iPSC来源自然杀伤细胞产品NCR300注射液。此外,该公司还有多款面向帕金森病和糖尿病等临床需求的iPSC衍生细胞药物也将陆续申报IND。
未来,iPSC衍生的细胞替代疗法可用于神经退行性疾病、脑出血、眼科、器官衰竭、炎症性疾病等病症。同时,iPSC衍生的通用型CAR-NK细胞及CAR-T细胞也可用于多种末线肿瘤疗法及中重度自身免疫性疾病。
在干细胞领域,通用型和可及性仍是讨论重点。近年来,干细胞创新药赛道风险逐渐释放,通用型应用场景会更大。如果用iPSC去做CAR-T,成本能大幅降低。
总体来看,中国在干细胞领域的研究和临床转化方面已经处于全球领先水平。未来,随着政策的持续支持和科研的不断突破,中国干细胞创新药领域将迎来更加广阔的发展前景。
郑重声明:以上内容与本站立场无关。本站发布此内容的目的在于传播更多信息,本站对其观点、判断保持中立,不保证该内容(包括但不限于文字、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关内容不对各位读者构成任何投资建议,据此操作,风险自担。股市有风险,投资需谨慎。如对该内容存在异议,或发现违法及不良信息,请发送邮件至yxiu_cn@foxmail.com,我们将安排核实处理。











